Diabetes e COVID-19: Perspectiva da IDF
Última atualização 16 de julho de 2020
___________________________________________________________________________
Resumo
O diabetes é um fator de risco para a progressão e prognóstico da doença por coronavírus (COVID-19), mas a relação entre o nível de hemoglobina glicosilada (HbA1c), a inflamação e o prognóstico dos pacientes com COVID-19 não foi explorada.
Métodos
Este foi um estudo retrospectivo de pacientes com COVID-19 submetidos a um teste de HbA1c. Seus dados demográficos, histórico médico, sinais e sintomas de COVID-19, resultados de exames laboratoriais e resultados finais do tratamento com COVID-19 foram coletados e analisados.
Resultados
Um total de 132 pacientes foram incluídos e divididos em três grupos com base no nível de glicose no sangue. Houve diferenças significativas em SaO 2 , nível sérico de ferritina, proteína C reativa (PCR), taxa de sedimentação de eritrócitos (VHS), nível de fibrinogênio (Fbg) e nível de IL6 entre os três grupos. Uma comparação pareada dos grupos mostrou que os grupos B e C eram significativamente diferentes do grupo A em termos de PCR, VHS e Fbg, IL6 e níveis séricos de ferritina (P <0,05). A análise de correlação mostrou que houve correlação linear negativa entre SaO 2 e HbA1c (r = -0,22, P = 0,01), enquanto houve correlação linear positiva entre ferritina sérica, PCR, Fbg e níveis de VHS e HbA1c (P <0,05 )
Conclusões
Alto nível de HbA1c está associado a inflamação, hipercoagulabilidade e baixo SaO 2 em pacientes com COVID-19, e a taxa de mortalidade (27,7%) é maior em pacientes com diabetes. Determinar o nível de HbA1c após a internação é, portanto, útil na avaliação da inflamação, hipercoagulabilidade e prognóstico dos pacientes com COVID-19.
___________________________________________________________________________
1 . Introdução
A doença de coronavírus (COVID-19) é causada pela síndrome respiratória aguda grave coronavírus 2 (SARS-CoV-2). Este vírus causa principalmente danos nos pulmões e no sistema imunológico. Atualmente, o COVID-19 é uma pandemia global e causou um grande número de mortes em muitos países. Vários estudos mostraram que a gravidade e a mortalidade com COVID-19 estão relacionadas à idade e comorbidades, incluindo diabetes, hipertensão, doenças cardiovasculares e cerebrovasculares [1] , [2] .
A HbA1c é considerada o padrão-ouro para avaliar o nível de glicose no sangue e fornece um valor médio nos últimos 3 meses, e o nível alto de HbA1c está relacionado ao risco de complicações em pacientes diabéticos [3] . No entanto, não foi relatado se o aumento do nível de HbA1c está relacionado à alta inflamação, hipercoagulabilidade e mortalidade em pacientes com COVID-19. Realizamos um estudo retrospectivo para avaliar o efeito do alto nível de HbA1c na mortalidade e inflamação em pacientes com COVID-19 com metabolismo anormal da glicose.
2 . materiais e métodos
2.1 . Participantes do estudo e sua avaliação
Durante o período de internação de 9 a 28 de fevereiro de 2020, foram determinados os níveis de HbA1c de 136 pacientes com COVID-19 positivo em 3 enfermarias do Hospital Wuhan Tongji. Quatro pacientes foram excluídos do estudo porque os seguintes fatores afetaram o nível de HbA1c: 2 pacientes estavam recebendo glicocorticóides para transplante renal e lúpus eritematoso sistêmico crônico; 1 era um paciente com anemia hemolítica; e 1 paciente apresentou mielossupressão após quimioterapia com leucemia. Após a exclusão desses pacientes, 132 pacientes foram finalmente incluídos. As características demográficas basais dos pacientes são apresentadas na Tabela 1. O COVID-19 foi diagnosticado com base no “O novo plano chinês de diagnóstico e tratamento para pneumonia por coronavírus (versão de teste sete)”, publicado pela Comissão Nacional de Saúde da República Popular da China [4] . O diabetes foi diagnosticado com base nos critérios de diagnóstico da OMS 2019 para diabetes [5]. Os pacientes COVID-19 foram divididos em três grupos: A, B e C. Os pacientes do grupo A não apresentaram diabetes e o nível de HbA1c foi ≤6,0; pacientes do grupo B não tinham diabetes e seu nível de HbA1c era> 6,0; pacientes do grupo C eram diabéticos. Havia 41 pacientes no grupo A, 44 pacientes no grupo B e 47 pacientes no grupo C. Trinta e um pacientes (66,0%) no grupo C tinham histórico de diabetes tipo 2 e 16 pacientes (34,0%) foram diagnosticados com diabetes; os pacientes com histórico de diabetes receberam mais de um medicamento hipoglicêmico oral antes da internação hospitalar (o medicamento mais comum recebido foi a metformina seguida de acarbose), dos quais 12 pacientes (25,5%) estavam em uso de insulina antes da admissão.
Tabela 1 . Dados demográficos e características basais dos pacientes com COVID-19.
| Não (%) Total (n = 132) | A (n = 41) | B (n = 44) | C (n = 47) | |
|---|---|---|---|---|
| Idade, mediana (IQR), y | 66,0 (56,0-72,0) | 64,0 (44,0-73,0) | 66,0 (58,0-71,0) | 68,0 (61,0-72,0) |
| Gênero | ||||
| Masculino | 68 (51,5) | 18 (43,9) | 21 (47,7) | 29 (61,7) |
| Fêmea | 64 (48,5) | 23 (56,1) | 23 (52,3) | 18 (38,3) |
| Comorbidades | ||||
| Hipertensão | 66 (50,0) | 18 (44,4) | 21 (47,7) | 27 (57,4) |
| Doença cardiovascular | 22 (16,7) | 7 (17,0) | 5 (11,4) | 10 (21,3) |
| Doença pulmonar | 9 (6,8) | 3 (7,3) | 4 (9,1) | 2 (4,3) |
| Doença cerebrovascular | 10 (7,6) | 2 (4,9) | 5 (11,4) | 3 (6,4) |
| Doença renal crônica | 10 (7,6) | 7 (17,1) | 0 0 | 3 (6,4) |
| Hemodiálise de manutenção | 7 (5,3) | 4 (9,8) | 0 0 | 3 (6,4) |
| Doença da tireóide | 2 (1,5) | 1 (2,4) | 1 (2,3) | 0 0 |
| sinais e sintomas | ||||
| Febre | 94 (71,2) | 26 (63,4) | 34 (77,3) | 34 (72,3) |
| Tosse | 96 (72,7) | 31 (75,6) | 27 (61,4) | 38 (80,9) |
| Fadiga | 39 (29,5) | 11 (26,8) | 14 (31,8) | 14 (29,8) |
| Falta de ar | 105 (79,5) | 32 (78,0) | 34 (77,3) | 39 (83,0) |
| Mialgia | 28 (21,2) | 6 (14,6) | 15 (34,1) | 7 (14,9) |
| Diarréia | 11 (8,3) | 3 (7,3) | 3 (6,8) | 5 (10,6) |
| SaO 2 na admissão, mediana (IQR),% | 95 (90-97) | 96 (93-97,5) | 95 (86,25–97) | 93 (85-96) |
| Tempo desde o início até a admissão, mediana (IQR), d | 14 (10,0–17,8) | 13,0 (8,5–18,5) | 15,0 (11-18,75) | 13,0 (9–17) |
Por se tratar de um estudo de coorte retrospectivo, os dados referentes às características do paciente, histórico médico, sintomas e sinais, resultados dos exames laboratoriais, saturação de oxigênio no sangue (SaO 2) na admissão e os resultados clínicos finais foram coletados de um sistema eletrônico de prontuário médico para análise. De todos os resultados dos exames laboratoriais, os valores mínimos de contagem sanguínea de leucócitos e linfócitos e os valores máximos de ferritina, PCR, interleucina, níveis de fator de necrose tumoral α (TNF-α) e desidrogenase lactato (LDH), fibrinogênio (Fbg) e taxa de sedimentação de eritrócitos (VHS) foram consideradas neste estudo. A data de início do COVID-19 foi considerada com base na data de início dos sintomas. Todos os pacientes foram tratados de acordo com o “O novo plano chinês de diagnóstico e tratamento para pneumonia por coronavírus (versão de teste sete)” e foram acompanhados até 6 de abril de 2020. O estudo foi aprovado pelo Comitê de Ética do Hospital Popular da Universidade de Pequim.
3 . análise estatística
As variáveis categóricas são expressas em termos de frequência e porcentagem e comparadas pelo teste do qui-quadrado. As variáveis contínuas são expressas como média ± desvio padrão para a distribuição normal e foram comparadas através da análise de variância. Mediana e intervalo interquartil (IQR) foram utilizados para distribuição assimétrica. Um valor de P <0,05 foi considerado estatisticamente significativo. Todas as análises estatísticas foram realizadas no programa SPSS Statistics for Windows, versão 24.0 (IBM, EUA).
4 . Resultados
Um total de 132 pacientes com teste positivo para COVID-19 submetidos ao teste de RNA SARS-CoV-2 foram incluídos em nosso estudo. A idade mediana dos pacientes foi de 66 anos (IQR 56-72 anos), variando de 24 a 88 anos. O número de homens foi de 68, enquanto o número de mulheres foi de 64. No total, 88 (66,7%) dos pacientes apresentavam comorbidades, sendo a hipertensão mais comum (50,0%), seguida de diabetes (35,6%), cardiovascular. ou doença cerebrovascular (24,2%) e doença renal crônica (7,6%). Sete pacientes apresentavam insuficiência renal crônica em hemodiálise de manutenção a longo prazo e receberam terapia renal substitutiva intermitente (TIRR) à beira do leito durante a hospitalização. O tempo médio desde o início até a admissão foi de 14 (IQR 10,0-17,8) dias. SaO 2foi de 95% (IQR 90-97%) sem inalação de oxigênio no momento da admissão, variando de 59% a 99% ( Tabela 1 ).
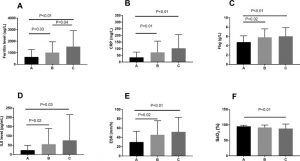
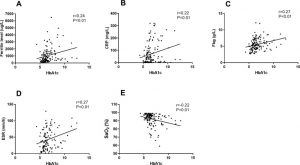
O nível médio de HbA1c foi de 6,4 (IQR 5,8–7,2%) e houve diferenças significativas entre os grupos em relação a vários parâmetros, incluindo SaO 2 , ferritina sérica, PCR, VHS, fibrinogênio (Fbg) e níveis de IL6 (P <0,01 , Tabela 2 ). Uma comparação pareada entre os grupos mostrou que as diferenças entre os grupos C e A e os grupos B e A foram estatisticamente significantes em termos de VHS, PCR, ferritina sérica, níveis de Fbg e IL6 ( Fig. 1 ). A análise de correlação revelou que houve uma correlação linear negativa entre SaO 2 e HbA1c, enquanto houve uma correlação linear positiva entre os níveis séricos de ferritina, PCR, Fbg e VHS e HbA1c ( fig. 2 ).
Tabela 2 . Comparação de parâmetros laboratoriais entre os três grupos de pacientes com COVID-19.
| Mediana (IQR) | ||||||
|---|---|---|---|---|---|---|
| Intervalo normal | Total (n = 132) | Grupo A (n = 41) | Grupo B (n = 44) | Grupo C (n = 47) | Valor p | |
| HbA1c (%) | 4.0-6.0 | 6,4 (5,8-7,2) | 5,7 (5,4-5,8) | 6,4 (6,2-6,5) | 7,5 (7,1-8,7) | <0,01 |
| Fbg (g / L) | 2.0-4.0 | 5,3 (4,3-6,8) | 4,6 (3,8-5,7) | 5,4 (4,4-7,0) | 5,8 (4,7-7,3) | <0,01 |
| Leucócitos (× 10 9 / L) | 3,5-9,5 | 4,9 (4,1-6,0) | 4,6 (3,9-5,3) | 5,0 (4,2-6,4) | 5,3 (4,1-6,8) | 0,12 |
| Linfócitos (× 10 9 / L) | 1.1-3.2 | 0,8 (0,5-1,3) | 0,8 (0,6-1,5) | 0,8 (0,5-1,4) | 0,8 (0,5–1,2) | 0,68 |
| Ferritina sérica (µg / L) | 30,0-400,0 | 668,3 (349,7-1488,3) | 372,8 (226-1064,9) | 734,3 (354,8–1502,9) | 1255,0 (564,3–2110,1) | <0,01 |
| LDH (U / L) | 135,0-225,0 | 289,0 (241,0-431,3) | 276,0 (226,0-319,0) | 325,0 (263,5-451,0) | 276,0 (239,0–473,0) | 0,64 |
| PCR (mg / L) | <1,0 | 38,3 (5,3-107,8) | 17,3 (2,9-61,7) | 41,6 (5,2-109,7) | 57,9 (11,0-185,6) | <0,01 |
| IL-1β (pg / mL) | <5,0 | 5,0 (5,0-5,0) | 5,0 (5,0-5,0) | 5,0 (5,0-5,0) | 5,0 (5,0-5,8) | 0,09 |
| IL-2 (U / mL) | 223,0–710,0 | 657 (416,1-1146) | 565,0 (378,5–974,0) | 739,5 (407,1-1164,8) | 808,0 (501,0–1336,0) | 0,09 |
| IL-6 (pg / mL) | <7,0 | 14,9 (4,0-56) | 12,7 (3,5-40,5) | 9,6 (3,2-64,5) | 29,6 (8,5-90,7) | 0,04 |
| IL-8 (pg / mL) | <62,0 | 16,1 (7,8-29,3) | 12,1 (7–17,0) | 18,5 (9,1-31,9) | 21,0 (7,3-43,2) | 0,15 |
| IL-10 (pg / mL) | <9,1 | 5,0 (5,0-7,5) | 5,0 (5,0-6,9) | 5,0 (5,0-6,9) | 21,0 (7,3-43,2) | 0,11 |
| TNF-α (pg / mL) | <8,1 | 9,2 (5,9-14,0) | 8,4 (5,3-13,9) | 8,7 (5,9-12,8) | 11,0 (6,9–15,9) | 0,17 |
| VHS (mm / h) | 0,0-15,0 | 37,0 (18-64) | 22,0 (9,0-53,0) | 39,5 (24,3-63,3) | 46,0 (20,0-82,3) | <0,01 |
| TG (mmol / L) | <1,7 | 1,5 (1,1-2,1) | 1,3 (1,0-1,9) | 1,2 (1,0-1,9) | 1,8 (1,3-2,3) | 0,08 |
Fig. 1 . Fatores inflamatórios na saturação sanguínea e de oxigênio entre os três grupos.
Fig. 2 . Análise de correlação de fatores inflamatórios, saturação de oxigênio no sangue e nível de HbA1c.
___________________________________________________________________________
Um total de 22 pacientes morreu (16,7%) durante a hospitalização, incluindo 4 óbitos no grupo A (9,8%), 5 óbitos no grupo B (11,40%) e 13 óbitos no grupo C (27,7%); Todos os pacientes foram submetidos à retirada terminal de ventilação mecânica. Houve diferença estatisticamente significante entre os grupos A e C em termos de taxa de mortalidade (P = 0,03, Tabela 3 ).
Tabela 3 . Taxa de mortalidade entre os três grupos de pacientes com COVID-19.
| Total (n = 132) | Grupo A (n = 41) | Grupo B (n = 44) | Grupo C (n = 47) | X 2 | P | |
|---|---|---|---|---|---|---|
| Sobreviventes | 110 | 37. | 39. | 34 | 6,39 | 0,04 |
| Não sobreviventes | 22 | 4 | 5 | 13 | ||
| Taxa de mortalidade | 16,7% | 9,8% | 11,40% | 27,7% |
Nota: Grupo A vs. B, P = 0,81; Grupo B vs. C, P = 0,05; Grupo A vs. C, P = 0,03.
5 . Discussão
Em nosso estudo, devido à presença de infecções virais agudas, não consideramos a HbA1c como o padrão diagnóstico para diabetes, de acordo com as diretrizes [5] . Este é o primeiro estudo a relatar que pacientes diabéticos que contraem COVID-19 têm inflamação mais grave e maior mortalidade [6] , e que marcadores de inflamações, como nível sérico de ferritina, nível de PCR e VHS nos casos de COVID-19 e o fator de coagulação Fbg foram positivamente correlacionados com o nível de HbA1c, enquanto SaO 2 correlacionou-se negativamente com o nível de HbA1c. Mesmo em pacientes com apenas nível elevado de HbA1c e sem diabetes, os níveis de marcadores de inflamação e Fbg também aumentaram significativamente ( fig. 1, P <0,05). No entanto, pouco se sabe sobre o mecanismo referente ao aumento dos níveis de marcadores de inflamação e do nível de HbA1c no caso de pacientes com COVID-19. Estudos anteriores demonstraram que o diabetes não apenas causa disfunção epitelial dos cílios pulmonares, aumento da permeabilidade do sistema vascular, dano epitelial alveolar e colapso alveolar, mas também contribui para a função anormal do sistema imunológico [7] , [8] . Da mesma forma, em pacientes com COVID-19 gravemente enfermo, as estruturas dos pulmões, baço e linfonodos são danificadas e a contagem de linfócitos é reduzida. [9]. Tanto o diabetes quanto o COVID-19 podem danificar sinergicamente os sistemas imunológico e respiratório. Além disso, pacientes diabéticos têm mais comorbidades devido às quais há mais danos nos órgãos-alvo; isso junto com o COVID-19 leva a uma inflamação mais grave, hipercoagulabilidade, oxigenação ainda baixa e, eventualmente, maior mortalidade.
Os pacientes com COVID-19 com nível mais alto de HbA1c podem exibir um nível de gravidade relativamente mais alto, e a própria infecção também pode levar a um aumento no nível de HbA1c. Estudos anteriores também descobriram que em pacientes com síndrome respiratória aguda grave (SARS), mesmo aqueles com sintomas leves (que não recebem terapia com glicocorticóide durante o curso da doença), apresentavam níveis mais altos de glicose no sangue em jejum [10] . Em nosso estudo, após excluir o tratamento com corticosteroides exógenos, hemólise, o nível de HbA1c de 66,7% (88/132) pacientes ainda era superior ao normal (4,0–6,0%), dos quais 12,1% (16/132) pacientes foram diagnosticados novamente com diabetes. Para os pacientes com diabetes de início recente, estudos relatados anteriormente juntamente com este estudo sugerem que o COVID-19 pode causar e agravar o metabolismo anormal da glicose.
Os possíveis mecanismos do COVID-19 que causam metabolismo anormal da glicose incluem danos às células das ilhotas β e resistência à insulina. Estudos anteriores relataram que alguns vírus podem causar diretamente danos às células β pancreáticas [11] , [12] e a enzima de conversão da angiotensina 2 (ACE2) como um receptor SARS-CoV-2 tem maior expressão nos tecidos endócrinos pancreáticos do que nos tecidos exócrinos [13] . A autópsia mostrou que, embora um pequeno número de células das ilhotas tenha se degenerado no tecido pancreático, enquanto a análise imuno-histoquímica e os testes de reação em cadeia da polimerase não detectaram a presença de SARS-CoV-2 nas células das ilhotas pancreáticas [9], indicando assim que não há evidências suficientes sobre o dano induzido por SARS-CoV-2 nas células das ilhotas. Os níveis de inibidor 1 do ativador do plasminogênio, PCR, amilóide sérico A, TNF-α, IL-1β e IL-6 demonstraram aumentar em pacientes obesos e diabéticos tipo 2. A IL-1β pode causar disfunção e apoptose das células das ilhotas β, e os níveis desses fatores podem ser reduzidos por alterações relacionadas ao estilo de vida e perda de peso, o que sugere que marcadores inflamatórios podem estar envolvidos no dano das células β das ilhotas e na resistência à insulina [14]. Os fatores inflamatórios liberados em resposta à SARS-CoV-2 também podem estar envolvidos nos danos das células β das ilhotas e na resistência à insulina, resultando em metabolismo anormal da glicose. Em nosso estudo, os pacientes tiveram 14 (IQR 10,0-17,8) dias desde o início dos sintomas até a admissão. O metabolismo anormal da glicose por um longo período de tempo pode causar um aumento no nível de HBV1c.
Existem algumas limitações neste estudo. Primeiro, foi um estudo retrospectivo, e o viés causado pela exclusão dos quatro pacientes pode ter afetado os resultados. Segundo, devido à limitação causada pelo número de óbitos, a análise de regressão multivariada não pôde ser realizada para determinar se o aumento no nível de HbA1c era um fator de risco independente para a morte de pacientes com COVID-19. Terceiro, após 3 anos de acompanhamento de pacientes com SARS, Yang et al. descobriram que os níveis de glicose no sangue em jejum, glicemia pós-prandial e insulina do grupo SARS e seus irmãos saudáveis não-SARS pareados eram semelhantes, sugerindo que os danos nas ilhotas e a resistência à insulina relacionados à SARS-CoV são de curta duração. Da mesma forma, se o aumento do nível de HBA1c em pacientes com COVID-19 é transitório também é incerto devido ao curto tempo de observação; conseqüentemente,
Em conclusão, a HbA1c está associada a inflamação, hipercoagulabilidade e baixa SaO 2 em pacientes com COVID-19, e a taxa de mortalidade é maior em pacientes diabéticos. A realização do teste de HbA1c após a admissão é útil para avaliar a inflamação, a hipercoagulabilidade e o prognóstico.
Reconhecimentos
Os autores gostariam de agradecer a contribuição dos membros da equipe de pesquisa. Este estudo foi apoiado por Natural Science Foundation do município de Beijing , China ( 7204321 ) e Fundos de Desenvolvimento da Universidade de Pequim Pessoas Hospital Investigação Científica ( 2019-02 ), Instituto Conjunto Michigan University Medicine-Pequim Health Science Center for Translational e Investigação Clínica ( BMU20160527 ).
Declaração de interesse concorrente
Declaramos que não há conflito de interesses.
Contribuição dos Autores
ZD e ZZW projetaram o estudo, escreveram e revisaram o manuscrito. FXZ revisou o manuscrito. Todos os autores leram e aprovaram o manuscrito final.
Referências
- [1]
-
J. Yang , Y. Zheng , X. Gou , et al.Prevalência de comorbidades na nova infecção por coronavírus Wuhan (COVID-19): uma revisão sistemática e metanáliseInt J Infect Dis ( 2020 ) , 10.1016 / j.ijid.2020.03.017
- [2]
-
F. Zhou , T. Yu , R. Du , et al.Curso clínico e fatores de risco para mortalidade de pacientes adultos internados com COVID-19 em Wuhan, China: um estudo de coorte retrospectivoLancet , 395 ( 10229 ) ( 2020 ) , pp. 1054 – 1062
- [3]
-
L. Nalysnyk , M. Hernandez-Medina , G. KrishnarajahVariabilidade glicêmica e complicações em pacientes com diabetes mellitus: evidências de uma revisão sistemática da literaturaDiabetes Obes Metab , 12 ( 4 ) ( 2010 ) , pp. 288 – 298
- [4]
- O novo plano chinês de diagnóstico e tratamento de pneumonia por coronavírus (versão de teste sete) http://www.nhc.gov.cn/yzygj/s7653p/202003/46c9294a7dfe4cef80dc7f5912eb1989.shtml .
- [5]
-
D. Kansagara , LL Humphrey , A. QaseemDiretrizes da organização mundial de saúde sobre medicamentos para intensificação do tratamento do diabetesAnn Intern Med , 170 ( 8 ) ( 2019 ) , pp. 583 – 584
- [6]
-
Nova equipe de epidemiologia de resposta a emergências de coronavírus e pneumoniaAs características epidemiológicas de um surto de novas doenças por coronavírus em 2019 (COVID-19) na ChinaZhonghua Liu Xing Bing Xue Za Zhi , 41 ( 2 ) ( 2020 ) , pp. 145 – 151
- [7]
-
BJ Philips , JX Meguer , J. Redman , EH BakerFatores que determinam o aparecimento de glicose nas secreções do trato respiratório superior e inferiorTratamento Intensivo Med , 29 ( 12 ) ( 2003 ) , pp. 2204 – 2210
- [8]
-
RB Klekotka , E. Mizgała , W. KrólEtiologia das infecções do trato respiratório inferior em pessoas com diabetesPneumonol Alergol Pol , 83 ( 5 ) ( 2015 ) , pp. 401 – 408
- [9]
-
XH Yao , TY Li , ZC He , et al.Relatório patológico de três casos de COVID-19 por autópsias minimamente invasivasZhonghua Bing Li Xue Za Zhi , 49 ( 2020 ) , p. E009
- [10]
-
JK Yang , Y. Feng , MY Yuan , et al.Níveis plasmáticos de glicose e diabetes são preditores independentes de mortalidade e morbidade em pacientes com SARSDiabet Med , 23 ( 6 ) ( 2006 ) , pp. 623 – 628
- [11]
-
E. Jaeckel , M. Manns , M. Von HerrathVírus e diabetesAnn NY Acad Sci , 958 ( 2002 ) , pp. 7 – 25
- [12]
-
M. Roivainen , S. Rasilainen , P. Ylipaasto , et al.Mecanismos de dano induzido por coxsackievirus em células beta pancreáticas humanasJ Clin Endocrinol Metab , 85 ( 1 ) ( 2000 ) , pp. 432 – 440
- [13]
-
JK Yang , SS Lin , XJ Ji , LM GuoA ligação do coronavírus SARS ao seu receptor danifica ilhotas e causa diabetes agudoActa Diabetol , 47 ( 3 ) ( 2010 ) , pp. 193 – 199
- [14]
-
F. Emanuela , M. Grazia , R. Marco de , L. Maria Paola , F. Giorgio , B. MarcoInflamação como elo entre obesidade e síndrome metabólicaJ Nutr Metab , 2012 ( 2012 ) , artigo 476380
- 1
-
Esses autores contribuíram igualmente.