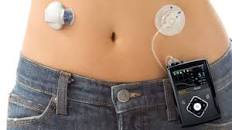
A FDA aprovou na sexta-feira uma proposta de teste de um kit de infusão de insulina que pode ser usado por 7 dias, de acordo com um comunicado de imprensa da Medtronic
Atualmente, os conjuntos de infusão de insulina disponíveis no mercado, tem uma longevidade padrão esperada de 2 ou 3 dias , o que gera alterações frequentes e potencialmente intrusivas do dispositivo e também dificulta a combinação com o monitoramento contínuo da glicose devido a diferentes tempos de ajuste , de acordo com o comunicado de imprensa. A Medtronic disse que seu sistema de uso mais longo abordará esses problemas com a “nova tecnologia adesiva” e o objetivo de garantir que a entrega de insulina permaneça estável.
“Houve avanços significativos nas três décadas com bombas de insulina e CGM. No entanto, ainda estamos presos em fazer com que os pacientes mudem os kits de administração de insulina a cada 2 a 3 dias, enquanto a maioria dos CGMs são usados por mais tempo”, Satish Garg, MD, professor de medicina e pediatria e diretor da divisão de diabetes da Barbara Davis. Centro da Universidade do Colorado, disse no lançamento. “É hora de um conjunto de infusão estender o desgaste para uma semana e além. Isso está muito atrasado e provavelmente irá melhorar a qualidade de vida dos pacientes com bombas de insulina, e muito mais pacientes podem aceitar a bomba de insulina como uma opção ”.
O estudo seguirá um desenho de estudo prospectivo multicêntrico, não randomizado. A Medtronic irá comparar a eficácia do dispositivo ao longo de 7 dias com a de dispositivos padrão em 150 adultos com diabetes tipo 1 com idades entre 18 e 80 anos que usam o dispositivo MiniMed 670G, de acordo com o comunicado de imprensa.
Divulgação: Garg informa que atuou em conselhos consultivos da Dexcom, Eli Lilly, Léxico, Mannkind, Medtronic, Merck, Roche e Sanofi, e recebeu bolsas de pesquisa em sua instituição da Animas, Dario, Dexcom, Eli Lilly, JDRF, Lexicon, Medtronic. , Merck, NIDDK, Novo Nordisk, Sanofi e T1D Exchange.
Fonte: Endocrine Today, 16/08/2019