O sistema automatizado de entrega de insulina de última geração da Medtronic , o MiniMed 780G , recebeu uma marca CE para o tratamento de diabetes tipo 1 em pessoas de 7 a 80 anos, o que significa que pode ser comercializado na União Europeia.
Esses sistemas rastreiam a glicose no sangue usando um monitor contínuo de glicose e fornecem insulina automaticamente quando necessário, usando uma bomba de insulina.
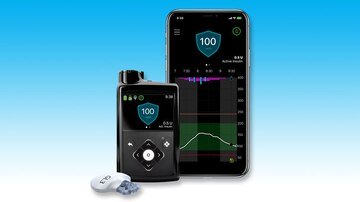
Dois novos recursos do sistema de circuito fechado híbrido avançado MiniMed 780G, em comparação com o MiniMed 670G, são conectividade Bluetooth e doses automáticas de correção de bolus, além de insulina basal a cada 5 minutos, que usa o algoritmo SmartGuard da empresa.
Assim, os usuários ainda precisam contar carboidratos e calcular suas doses de insulina pré-refeição em bolus, mas se esquecerem ou calcularem incorretamente, o sistema o corrigirá automaticamente para atingir a meta sem a contribuição do usuário. O alvo de glicose no sangue ajustável pode ser definido como 100 mg / dL, em comparação com os 120 mg / dL anteriores. E, como no 670G, o 780G ainda suspenderá a administração de insulina para um nível baixo de glicose previsto.
O 780G, que usa a tecnologia da DreaMed Diabetes, inclui conectividade Bluetooth para que pacientes e outros usuários designados possam ver os níveis e tendências de glicose em tempo real em aplicativos compatíveis para smartphones iOS e Android. E há menos configurações que os profissionais de saúde precisam ajustar do que nos sistemas anteriores.
“Continuando a aumentar a automação dos sistemas de bomba de insulina, podemos reduzir ainda mais a carga de pessoas que sofrem de diabetes e, ao mesmo tempo, levar a resultados clínicos positivos”, disse Moshe Phillip, MD, diretor do Instituto de Endocrinologia e Diabetes, Centro Nacional de Diabetes Infantil , Centro Médico Infantil Schneider de Israel, e co-fundador e diretor científico, DreaMed Diabetes, em uma declaração da Medtronic.
Ainda hoje, durante as 80ª Sessões Científicas virtuais da Associação Americana de Diabetes (ADA) , os dados serão apresentados a partir do estudo principal enviado para a marca CE, o ensaio cruzado randomizado de AHCL (New Zealand Advanced Hybrid Advanced Loop).
Durante a mesma sessão, serão relatados os resultados do estudo de segurança central da AHCL dos EUA, que fará parte do envio da FDA (Food and Drug Administration) da empresa para o 780G, bem como uma comparação dos 780G e 670G que não são relacionada às submissões regulatórias, a porta-voz da Medtronic, Pamela Reese, disse ao Medscape Medical News .
O 780G deve começar a ser comercializado ainda este ano em países selecionados da Europa.
A empresa ainda não anunciou quando a submissão do FDA ocorrerá, disse Reese.
Fonte: Medscape- Diabetes e Endocrinologia – Por: Miriam E. Tucker- 12 de junho de 2020